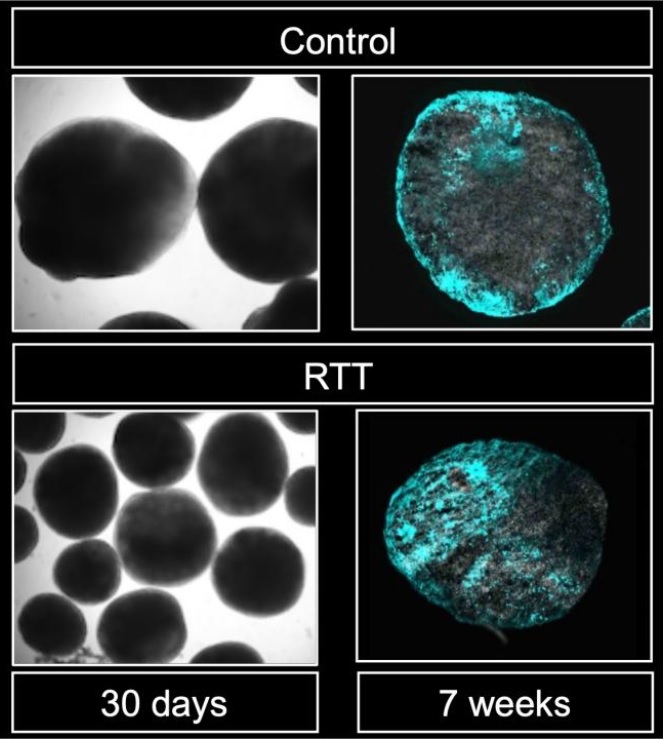
Sur la piste du mécanisme génétique sous-jacent au syndrome de Rett, cette équipe de chercheurs médecins de l’Université de Kyushu (Japon) identifie le dysfonctionnement d'un gène clé qui amène les cellules souches neurales à produire plus d'astrocytes (en bleu sur visuel) que de neurones. Ces travaux, publiés dans les Cell Reports révèlent ainsi une voie génétique sous-jacente au dysfonctionnement neurologique associé au syndrome de Rett.
Le syndrome de Rett est une maladie génétique définie par une anomalie sévère du développement du système nerveux central, il survient uniquement chez les filles. Le syndrome entraîne une déficience intellectuelle et motrice sévère. Sa prévalence en Europe est d’environ 1/10.000 à 1/15.000 filles, et de 25 à 40 nouveaux cas par an en France. Le syndrome est souvent diagnostiqué tardivement, car les enfants semblent se développer normalement au cours des 6 à 18 premiers mois.
Une pathologie moléculaire identifiée, à l’origine des déficiences du syndrome
En identifiant ces déficiences dans les gènes clés impliqués dans la pathologie qui incitent les cellules souches neurales à générer moins de neurones et à produire plus d'astrocytes -en charge de la maintenance du cerveau-, ces travaux désignent de nouvelles cibles thérapeutiques pour le syndrome de Rett.
Le syndrome de Rett est causé par des mutations dans un seul gène appelé protéine de liaison méthyl-CpG 2, ou MeCP2. Ce gène a été identifié depuis plus de 20 ans, cependant le mécanisme initié par les mutations conduisant à la pathogenèse était resté incompris, explique l’auteur principal, le Dr Hideyuki Nakashima de l'Université de Kyushu. Son équipe avait précédemment découvert que MeCP2 agit comme un régulateur pour le traitement de microARN spécifiques qui participent au contrôle des fonctions neuronales. Les chercheurs ont donc voulu regarder si cette voie était également impliquée dans la différenciation des cellules souches neurales.
Par rapport à l'ARN messager, la matrice finale transcrite à partir de l'ADN et utilisée par une cellule pour synthétiser les protéines, les microARN – ou miARN – sont beaucoup plus petits et agissent pour réguler l'ARN messager pour s'assurer que la cellule produit la quantité correcte de la quantité de protéines adaptée.
Ici, les scientifiques identifient plusieurs microARN associés à MeCP2, mais un seul affecte la différenciation des cellules souches neurales :
ce microARN appelé « miR-199a », contribue à augmenter la production d’astrocytes.
Les astrocytes sont des cellules de « soutien » du cerveau. Alors que les neurones déclenchent les signaux électriques, les astrocytes sont là pour assurer la maintenance du système. Cependant, au cours du développement, les astrocytes et les neurones sont générés à partir du même type de cellules souches, les cellules souches neurales, dont la production est soigneusement contrôlée.
Le dysfonctionnement de MeCP2 ou de miR-199a amène ces cellules souches à produire plus d'astrocytes que de neurones. Précisément, miR-199a cible la protéine Smad1, un facteur de transcription essentiel au bon développement cellulaire. Smad1 fonctionne en aval d'une voie appelée signalisation BMP, connue pour inhiber la production de neurones et faciliter la génération d'astrocytes.
La preuve sur un organoïde cérébral : cette forme de culture de cellules souches neurales en 3D permet de reproduire certains aspects du développement cérébral. Ici, l’organoïde a été développé à partir de cellules souches neurales dérivées de patients atteints du syndrome de Rett. Et lorsque les chercheurs inhibent la voie BMP, les anomalies de différenciation des cellules souches neurales sont considérablement réduites.
Ces travaux identifient ainsi plusieurs cibles nouvelles dans le syndrome de Rett : MeCP2, miR-199a et BMP, autant de pistes à explorer pour de nouveaux traitements.
Source: Cell Reports May 18, 2021 DOI : 10.1016/j.celrep.2021.109124 MeCP2 controls neural stem cell fate specification through miR-199a-mediated inhibition of BMP-Smad signaling
Plus sur Neuro Blog
